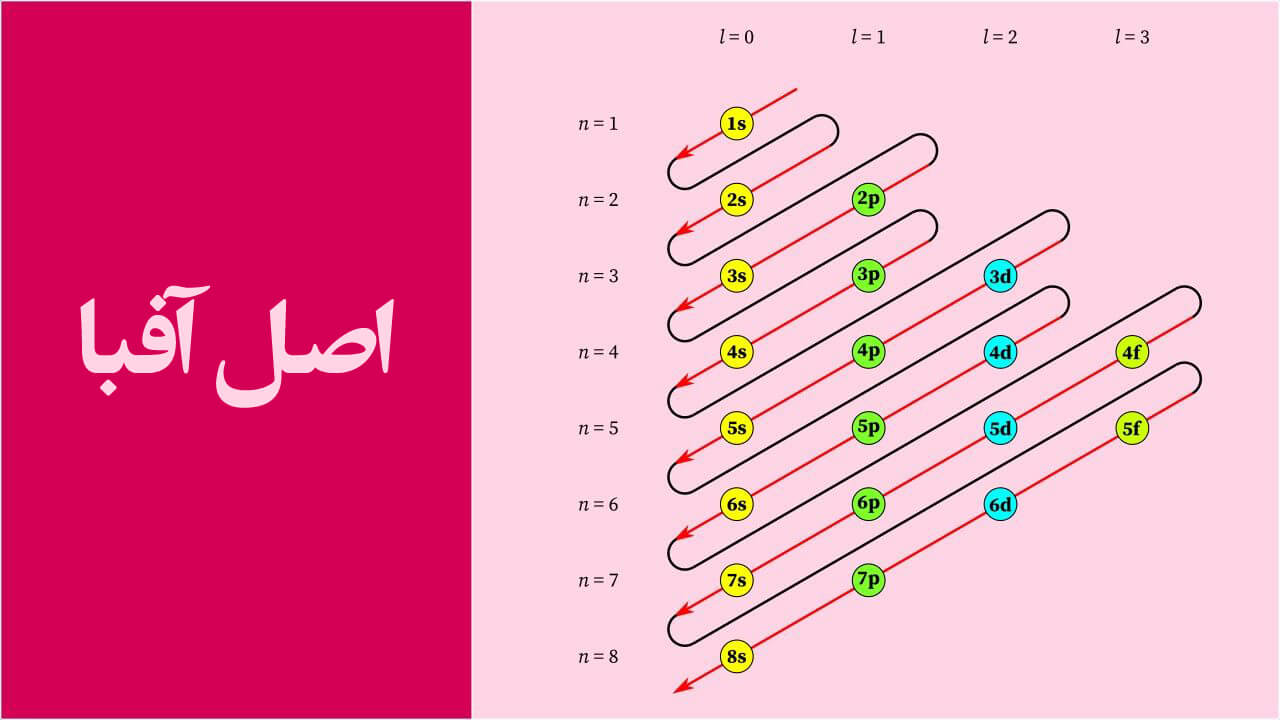
آفبا
اصل آفبا چیست؟ به نحوه پر شدن اوربیتالهای اتمی یک اتم توسط الکترونها در حالت پایه میپردازد. آفبا بیان میکند که الکترونها با ترتیب افزایش سطح انرژی اتمی، آنها را پر میکنند. بر اساس این اصول، با انرژی کمتر، پیش از اوربیتالهای با سطوح انرژی بالاتر و توسط الکترونها پر میشوند.
از نظر آژانس طراحی جاسینا و اصل آفبا معنی آفبا در آلمانی به معنای ساختن است و تشکیل اوربیتال به معنای پر کردن با الکترون است همچنین بیان می کند که الکترون های موجود اتمی به ترتیب صعودی انرژی پر شده اند و انرژی با استفاده از قانون “n+l” محاسبه می شود که بیان می کند آیا الکترونی با تعداد بیشتری از مقدار n+l انرژی بیشتری دارد یا خیر. در قاعده ای که در خط قبل مورد بحث قرار گرفت، n عدد کوانتومی اصلی و l عدد کوانتومی ازیموتالی را بیان می کند.
قانون آفبا می گوید اگر دو الکترون مقدار “n+l” یکسانی داشته باشند و الکترونی با مقدار کمتر n انرژی کمتری دارد و ابتدا پر می شود. ترتیب پر شدن آنها در در زیر مورد بحث قرار گرفته است.
اصل آفبا چیست؟
کلمه «آفبا» ( Aufbau Principle )، ریشهای یونانی دارد و میتوان آنرا به معنای «بنا کردن» (Construct) دانست به همین دلیل، در برخی از متون با نام «اصل بناگذاری آفبا» (Building-Up Principle) از آن یاد میشود.
همچنین روش اساسی است که به ما می گوید چگونه الکترون ها پر می شوند. طبق آن ، پر شدن در حالت پایه یک اتم از یک الگوی اساسی پیروی می کند. آژانس طراحی جاسینا در این اصل به ما می گوید که موارد موجود در آنها به ترتیب صعودی انرژی خود پر می شوند و برای یافتن انرژی از قانون “n+l” پیروی می کنند.
در این مقاله از آژانس طراحی جاسینا با آفبا، ویژگی ها، استثناها، محدودیت ها و موارد دیگر به تفصیل آشنا خواهیم شد.
تاریخچه
دانشمندان مختلفی برای توسعه آفبا به زبان ساده تلاش کردهاند و ترتیب در مدلهای قدیمی مکانیک کوانتوم دیده شده که توسط «نیلز بور» (Niels Bohr) در اوایل دهه ۱۹۲۰ ارائه شده است. در پایان این دهه، «شارل ژانت» (Charles Janet)، مهندس فرانسوی، شکل دیگری از جدول تناوبی موسوم به «Left-Step» را ارائه داد که بر مبنای قانون بنا شده بود. مفهوم این قانون در سال ۱۹۳۶ توسط «اروین مادلونگ» (Erwin Madelung) بیان شد و وی، پرشدن را با این قانون توصیف کرد و در سال ۱۹۶۲، دانشمند روسی، «سیوولود کلاچکوفسکی» (Vsevolod Klechkovsky)، توضیحاتی علمی را برای این قانون با استفاده از «مدل توماس-فرمی» (Thomas–Fermi Model) ارائه داد.
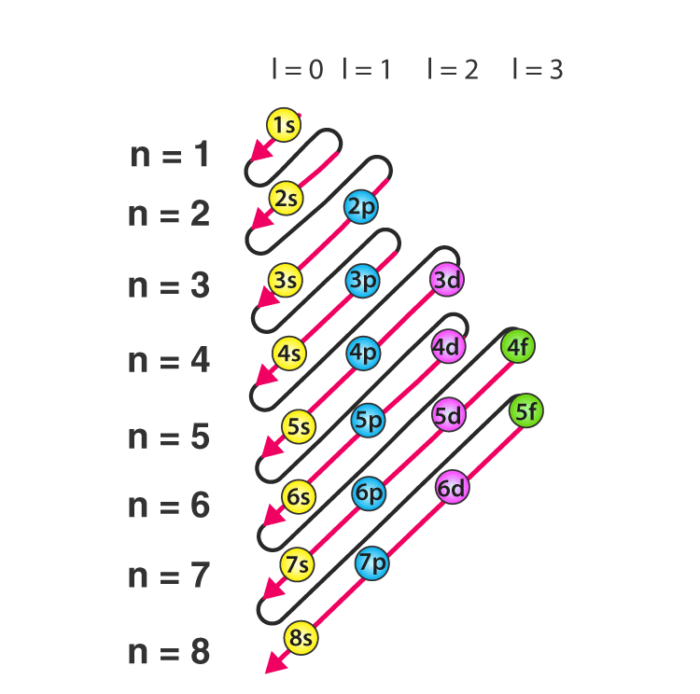
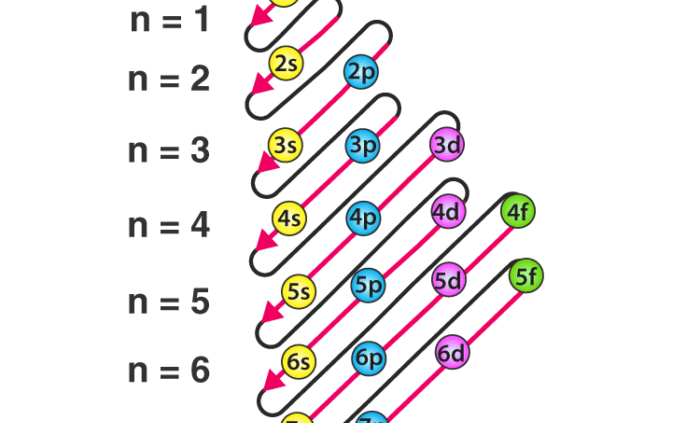
نمودار
نمودار قاعده آفبا طراحی شده ای است که ترتیب پر شدن الکترون های یک اتم را نشان می دهد.
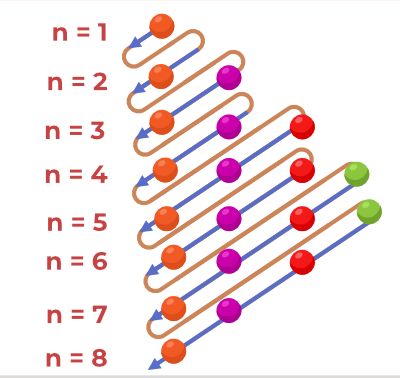
فرمولی از آفبا است که ترتیب پر شدن را بیان می کند.
کلاس اصل آفبا
الکترونهای موجود در اوربیتال اتمی یک اتم به ترتیب صعودی که با استفاده از قانون (n+l) محاسبه میشود، پر میشوند.
ترسیم نمودار آفبا
نمودار قاعده آفبا با استفاده از مراحل اضافه شده در زیر توسط آژانس طراحی جاسینا ترسیم شده است.
- تعدادی که باید در اتم ها پر شوند را بیابید.
- ما می دانیم که در یک اتم
- s می تواند حداکثر ۲ الکترون را در خود نگه دارد.
- p حداکثر ۶ را در خود نگه می دارد.
- d می تواند حداکثر ۱۰ را در خود نگه دارد.
- اوربیتال f می تواند حداکثر ۱۴ را در خود نگه دارد.
- دو الکترون اول را در اوربیتال ۱ پر کنید.
- سپس قانون “n+l” را دنبال کنید و سپس آنها را بر اساس آن پر کنید.
ویژگی های برجسته
ویژگی های مختلف از قاعده ی اصل آفبا نظر آژانس طراحی جاسینا عبارتند از:
- انرژی یک اوربیتال به مجموع مقادیر عدد کوانتومی اصلی (n) و عدد مجموع آزیموتالی (I) بستگی دارد و این قانون (n + l) نامیده می شود .
- در یک اتم ایزوله خنثی، هر چه مقدار (n + l) برای یک اوربیتال کمتر باشد، انرژی آن کمتر است. با این حال، اگر دو نوع مختلف مقدار یکسانی داشته باشند (n + l)، آنگاه دسته هایی با مقدار کمتر n انرژی کمتری دارند.
| نوع اوربیتال | مقدار n | ارزش l | مقدار n+l | انرژی نسبی |
|---|---|---|---|---|
| ۱s | ۱ | ۰ | ۱+۰ = ۱ | کمترین انرژی |
| ۲ ثانیه | ۲ | ۰ | ۲+۰ = ۲ | انرژی بالاتر از اوربیتال ۱s |
| ۲p
۳s |
۲
۳ |
۱
۰ |
۲+۱ = ۳
۳+۰ = ۳ |
اوربیتال های ۲p(n=2) انرژی کمتری نسبت به ۳s(n=3) دارند. |
| ۳p
۴s |
۳
۴ |
۱
۰ |
۳+۱ = ۴
۴+۰ = ۴ |
اوربیتال های ۳p(n=3) انرژی کمتری نسبت به ۴s(n=4) دارند. |
| ۳ بعدی
۴p |
۳
۴ |
۲
۱ |
۳+۲ = ۵
۴+۱ = ۵ |
اوربیتال های سه بعدی (n=3) انرژی کمتری نسبت به ۴p(n=4) دارند. |
از توضیحات ارائه شده در جدول، چنین بر می آید که انرژی مختلف با افزایش تعداد عدد کوانتومی اصلی افزایش می یابد.
- بنابراین ترتیبی که در آنها پر می شوند به صورت ۱s، ۲s، ۲p، ۳s، ۳p، ۴s، ۳d، ۴p، ۵s، ۴d، ۵p، ۶s، ۴f، ۵d، ۶p، ۷s است . ۵f، ۶d، ۷p…
پیکربندی الکترونیکی با استفاده از آفبا
پیکربندی الکترونیکی با استفاده از قاعده آفبا برای چند عنصر مورد بحث قرار گرفته است:
پیکربندی الکترونی گوگرد
عدد اتمی گوگرد ۱۶ است یعنی ۱۶ الکترون دارد
اکنون با استفاده از این اصل و پیکربندی الکترونیکی گوگرد به صورت زیر نوشته می شود:
[S] = 1s ۲ ۲s ۲ ۲p ۶ ۳s ۲ ۳p ۴
پیکربندی الکترونی نیتروژن
عدد اتمی نیتروژن ۷ است یعنی ۷ الکترون دارد
اکنون با استفاده از اصل آفبا و پیکربندی الکترونیکی نیتروژن به صورت زیر نوشته می شود:
[N] = 1s ۲ ۲s ۲ ۲p ۳
استثناها
چند استثنا وجود دارد که کروم و مس هستند و پیکربندی الکترونیکی آنها این است
پیکربندی الکترونیکی کروم
پیکربندی الکترونیکی Chromium طبق این اصل باید باشد
- Cr(24): [Ar]3d ۴ ۴s ۲
اما پیکربندی فوق صحیح نیست زیرا پیکربندی الکترونیکی واقعی Chromium(Cr) به این صورت است:
- Cr(24): [Ar]3d ۵ ۴s ۱
دلیل این پیکربندی الکترونیکی این است که اوربیتال d-اتمی نیمه پر پایدارتر از اوربیتال پر شده طبق اصل آفبا است.
پیکربندی الکترونیکی مس
پیکربندی الکترونیکی مس باید به صورت زیر باشد:
- Cu(29): [Ar]3d ۹ ۴s ۲
از نظر آژانس طراحی جاسینا پیکربندی فوق صحیح نیست زیرا پیکربندی الکترونیکی واقعی و مس (Cu) به این صورت است
- Cu(29): [Ar]3d ۱۰ ۴s ۱
دلیل این پیکربندی الکترونیکی این است که اوربیتال d-اتمی پر از اوربیتال پر شده و طبق اصل آفبا پایدارتر است .

دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.